2.4. ESTRATEGIAS CROMATOGRÁFICAS (II)
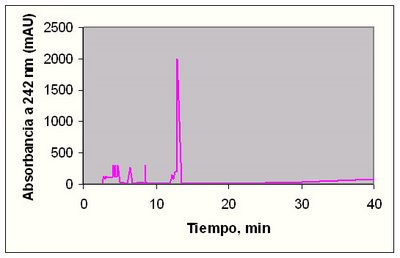 Figura 1.5.- Cromatograma reconstruido para los datos DAD a 242 nm , que corresponde a los mejillones tóxicos. Condiciones: 25 cm x 4,6 mm i.d. Columna Vydac 20 1TP con 1,0 ml/min CH3CN/CF3COOH; gradiente de elución de 5,0:94,9:0,1 a 99,9:0:0,1 por encima de 40 min.
Figura 1.5.- Cromatograma reconstruido para los datos DAD a 242 nm , que corresponde a los mejillones tóxicos. Condiciones: 25 cm x 4,6 mm i.d. Columna Vydac 20 1TP con 1,0 ml/min CH3CN/CF3COOH; gradiente de elución de 5,0:94,9:0,1 a 99,9:0:0,1 por encima de 40 min.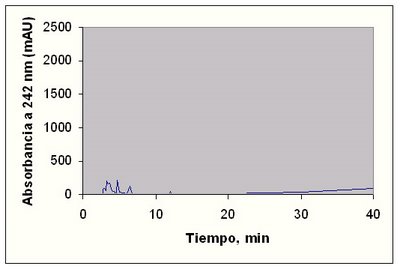
Figura 1.6.- Cromatograma reconstruido para los datos DAD a 242 nm , que corresponde a los mejillones de control. Condiciones: 25 cm x 4,6 mm i.d. Columna Vydac 20 1TP con 1,0 ml/min CH3CN/CF3COOH; gradiente de elución de 5,0:94,9:0,1 a 99,9:0:0,1 por encima de 40 min.
Como se observa en las anteriores figuras, a 242 nm las diferencias se muestran con muchísima intensidad. Lo que se pueden comprobar en las figuras siguientes.
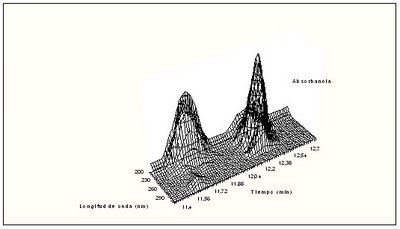
Figura 1.7.- Diagrama tridimensional, que relaciona longitud de onda, tiempo y absorbancia.
El pico de la izquierda corresponde al triptófano
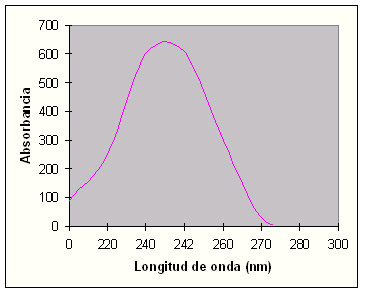
Figura 1.8.- Diagrama absorbancia-longitud de onda. El máximo se produce a 242 nm.
Al realizar los cromatogramas de dos fracciones extractivas con HPLC-DAD, en condiciones en que se supone que el compuesto tóxico desconocido es polar e ionizable (como un péptido, por ejemplo).
En la muestra tóxica, los cromatogramas a 220 *- 10 nm indican un pico claro, alrededor de los 12 min (justo detrás del pico del triptófano). Este pico no lo presenta la muestra control. Este cromatograma se obtiene con la fracción positiva obtenido con la columna de intercambio iónico XAD-2.
Inicialmente se seleccionó 220 nm porque a esta longitud de onda absorben numerosos compuestos. La representación tridimensional de los datos de HPLC-DAD para la fracción tóxica da información sobre un pico a 242 nm. El cromatograma a dicha longitud de onda revela claramente la dicotomía entre muestra tóxica y muestra control.
La absorción a 242 nm sugiere que el compuesto tóxico tiene un sistema conjugado, tal como:
- C = C – C = C -
Cuando esta fracción, obtenida por XAD-2, se analiza por NVPE se observa una banda al lado del ácido glutámico que al ser revelada con ninhidrina da un color más amarillo que rojo. Esta banda se observa en la fracción tóxica, pero no en la de control.
Por otra parte, la fracción de HPLC-DAD que contiene el pico, al ser recogida y sometida a electroforesis genera la banda anteriormente mencionada, lo que confirma la presencia del compuesto tóxico.
Comentarios